
Cette page est la correction d'une évaluation. Voir le sujet à imprimer
On plonge une lame de cuivre et une lame de zinc dans une solution de sulfate de cuivre et on les relie par des fils de connexion à un petit moteur.
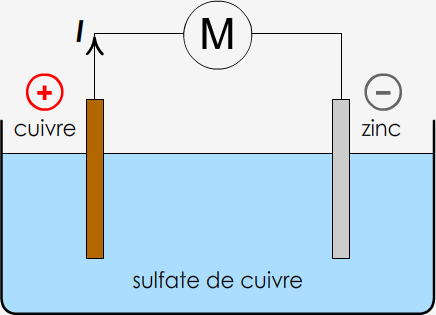
a) Comment fabriquer une pile électrochimique en général, celle décrite ici n'étant qu'un exemple particulier ? Réponse
Une pile électrochimique comporte deux électrodes de natures différentes plongeant dans une solution conductrice.
b) Indiquer sur le schéma le signe de chaque borne et le sens du courant, en justifiant vos choix. Réponse
Cette pile consomme du zinc. Les électrons sont fournis par le zinc au circuit. Le courant va en sens inverse des électrons, du + vers le -.
c) Pourquoi la solution se décolore-t-elle ? Réponse
Cette pile consomme des ions cuivre II, Cu2+, qui sont responsables de la couleur bleu de la solution.
d) Quels sont les réactifs (corps qui disparaissent) ? Quel est le nom de l’énergie qu’ils contiennent ? Réponse
Le zinc et les ions cuivre disparaissent.
Ils contiennent de l'énergie chimique.
e) Quelle est la conversion d’énergie réalisée par la pile ? Réponse
Une partie de l’énergie chimique des réactifs est transférée au circuit sous forme d’énergie
électrique.
Une autre partie sous forme de chaleur.