Expérience :
AVANT :
APRÈS :
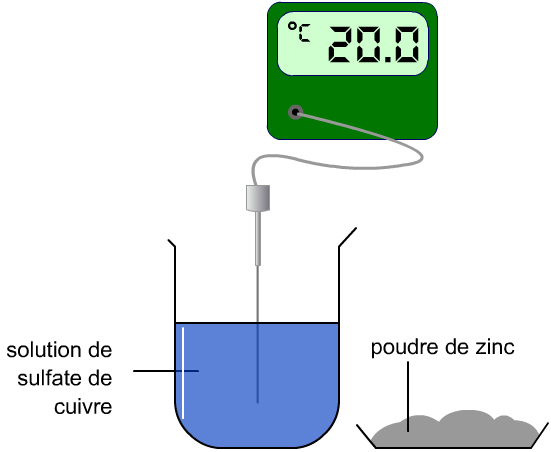
- On verse une solution de sulfate de cuivre dans un bécher.
- On mesure la température.
- On ajoute de la poudre de zinc, on agite et on relève à nouveau la température.
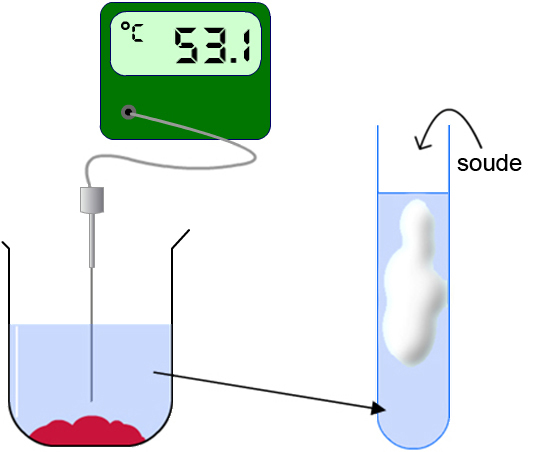
- On teste à la soude la solution obtenue.
Observations :
1. couleur bleue disparaît ;
2. dépôt rougeâtre sur le zinc ;
3. PP blanc avec la soude ;
4. θ ↗ .
Interprétations :
1. disparition des ions cuivre Cu2+ ;
2. apparition du métal cuivre ;
3. apparition des ions zinc Zn2+ ;
4. la transformation chimique libère de l’énergie thermique.
Expérience :
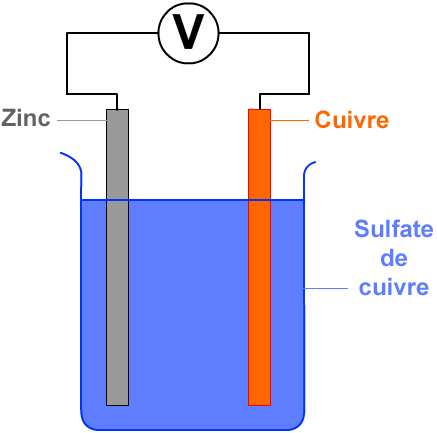
U = ………… V
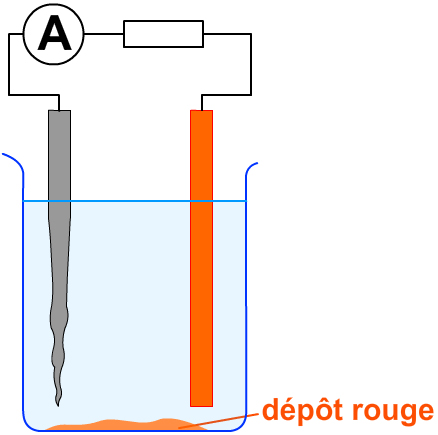
I = ………… mA
- On plonge une lame de zinc et une lame de cuivre dans une solution de sulfate de cuivre. On relie les lames aux bornes d’un voltmètre.
- On remplace le voltmètre par un dipôle ohmique.
- On mesure l’intensité.
Observations :
1. la solution se décolore ;
2. dépôt rougeâtre ;
3. du zinc disparaît ;
4. Les appareils montrent qu’il y a une tension et une intensité.
Interprétations :
1. disparition des ions cuivre Cu2+ ;
2. apparition du métal cuivre ;
3. la pile s’use ; apparition d'ions zinc Zn2+ ;
4. la transformation chimique libère de l’énergie électrique.
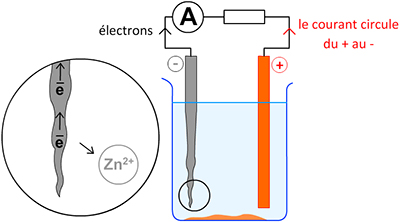
Zn → Zn2+ + 2 e
Réaction à l’électrode en cuivre : Du cuivre apparaît donc des électrons disparaissentCu2+ + 2 e → Cu
Le zinc donne des électrons aux ions cuivre qui deviennent atomes. Si les électrons apparaissent à la lame de zinc, c’est que le zinc est la borne négative de cette pile "artisanale".