
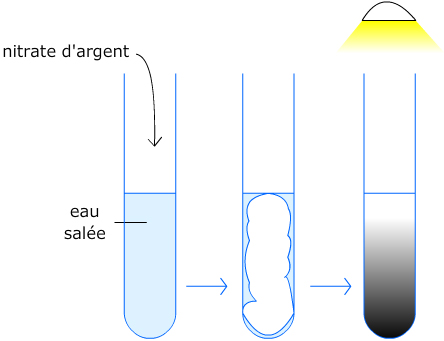
Expérience 1 : Identification des ions chlorure Cl-
L’eau salée contient des ions chlorure Cl- et des ions Na+.
- Ajoutons quelques gouttes d’une solution de nitrate d’argent à de l’eau salée contenue dans un tube à essai.
- Exposons le tube à la lumière.
Observations :
- Le contenu du tube se trouble ;
- Un « nuage » blanc se forme ;
- A la lumière, il devient noir.
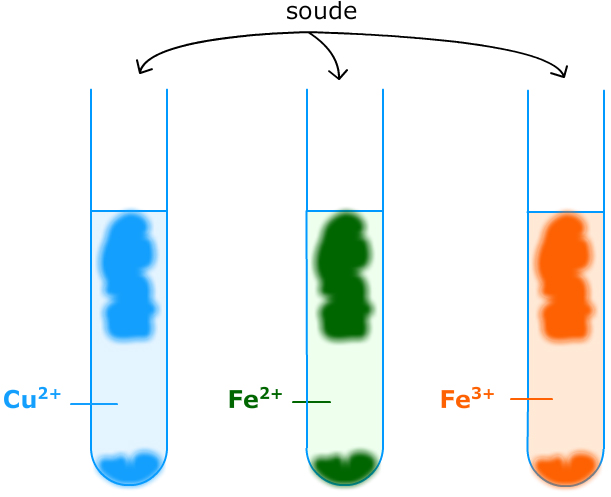
Expérience 2 : Identification des ions cuivre II, fer II et fer III
Formules respectives : Cu2+, Fe2+ et Fe3+.
La solution de sulfate de cuivre contient des ions cuivre. Celle de sulfate de fer II des ions fer II et celle de chlorure de fer III des ions fer III On verse quelques gouttes d’hydroxyde de sodium (soude) dans chacune de ces solutions.
Observations :
- Un précipité bleu avec les ions Cu2+ ;
- Un précipité vert avec les ions Fe2+ ;
- Un précipité rouille avec les ions Fe3+ ;
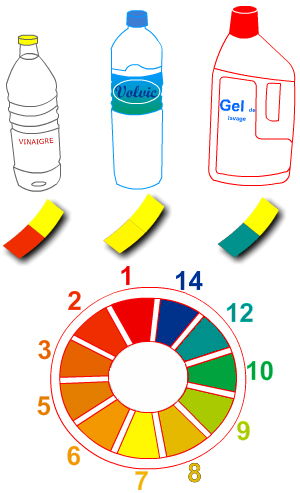
Expérience : On dispose de trois solutions :
- du vinaigre blanc ;
- une eau minérale Volvic ;
- du liquide pour lave-vaisselle.
On mesure le pH de chaque solution.
Observations :
Le papier pH devient
- rouge (pH ≈ 2) avec le vinaigre,
- jaune (pH ≈ 7) avec l’eau
- bleu (pH ≈ 12) avec le gel.
Interprétation :
Le pH d’une solution aqueuse permet de
savoir si cette solution est acide, neutre ou
basique.
pH < 7 : acide
pH = 7 : neutre
pH > 7 : basique
Remarque 1 : Les solides ioniques (cristaux de sel) ne conduisent pas le courant car les ions ne peuvent pas s'y déplacer.
Remarque 2 : Les ions métalliques sont tous positifs. Cu2+, Zn2+, Al3+…
Remarque 3 : Il existe des ions polyatomiques : ion ammonium NH4+, ion permanganate MnO4‐, ion sulfate SO42‐…
Expérience : On dispose d’un produit d’entretien acide A :
- Verser 90 mL d’eau distillée dans 3 béchers ;
- Verser 10 mL du produit dans le 1e bécher. Agiter.
- Verser 10 mL du 1e dans le 2e ;
- Verser 10 mL du 2e dans le 3e ;
- Mesurer les trois pH.
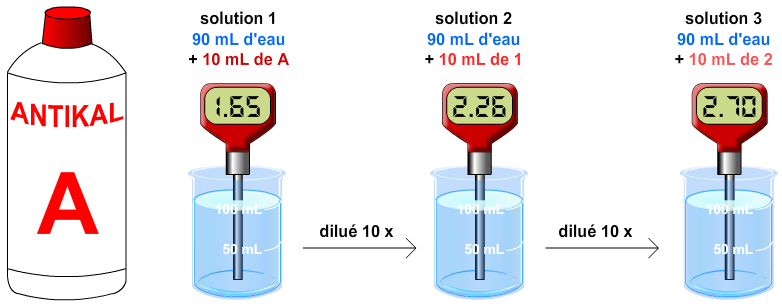
| solution | 1 | 2 | 3 |
| pH | 1.65 | 2.26 | 2.70 |