
Cette page est la correction d'une évaluation. Voir le sujet à imprimer
EXERCICE 1 : On laisse de la paille de fer dans de l’acide chlorhydrique.
a) Ecrire en toutes lettres l’équation-bilan de la réaction chimique : Réponse
fer + acide chlorhydrique → dihydrogène + solution de chlorure de fer II
b) Quels sont les ions présents dans la solution résiduelle (à la fin de la réaction) ? Réponse
ions Fe2+ et Cl-
c) Comment prouver par l’expérience que ces ions sont bien présents (tests) ?
• L'ion positif : ? Fe2+ : On fait le test à la soude. Si un précipité vert apparait, les ions fer II sont présents.
• L'ion négatif : ? On fait le test au nitrate d'argent. Si l'échantillon montre un précipité blanc qui noircit à la lumière, alors les ions chlorure Cl- sont présents en grande quantité.
EXERCICE 2 : On introduit un petit clou en fer dans un tube à essai contenant de l’acide chlorhydrique. On suit la réaction en notant le pH toutes les heures :
| temps (heures) | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|---|
| pH | 2,0 | 3,5 | 4,5 | 5 ,0 | 5,2 | 5,2 | 5,2 |
a) Représenter sur le graphique l’évolution du pH en fonction du temps. Lisser la courbe (éviter de relier les points deux à deux à la règle).
Réponse
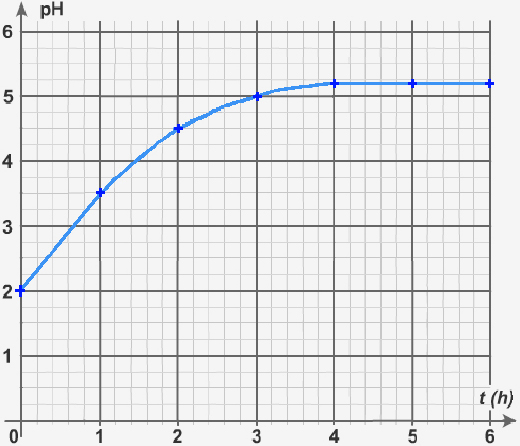
b) La réaction s’arrête. Pour quelle raison ? au bout de combien de temps ? Réponse
Lorsque le pH n'évolue plus, il reste inférieur à 7.
Les ions H+ sont donc encore présents en grand nombre.
Dans cet exemple, la réaction s'arrête donc quand le fer a disparu, au bout de 4 heures.