
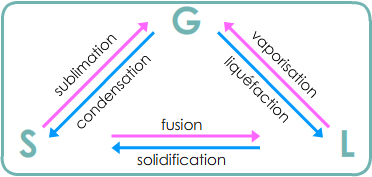
1.1. Écriture symbolique d'un changement d'état
Le changement d'état d'une espèce chimique A peut s'écrire à l'aide d'une équation :
A(état 1) → A(état 2)
Exemple : La fusion de la glace d'eau pure peut s'écrire :
eau(s) → eau(ℓ)
1.2. Ne pas confondre fusion et dissolution
Fusion : La séparation des entités est un effet de l'agitation thermique :
espèce(s) → espèce(ℓ)
Dissolution : C'est un solvant qui sépare les entités du soluté :
espèce(s, ℓ ou g) → espèce(aq)
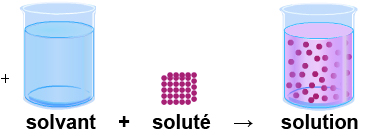
Dissolution
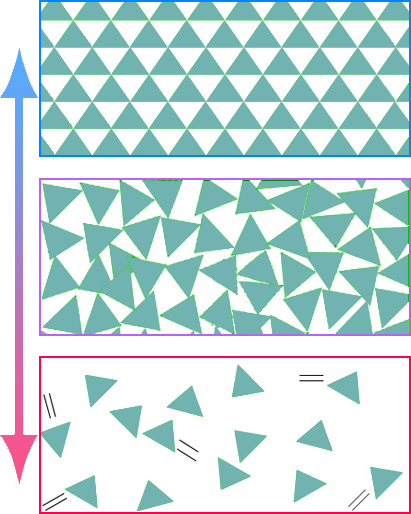
1.3. Modèles microscopiques
L'énergie cinétique d'agitation microscopique se limite ici aux vibrations. Un apport d'énergie peut donner aux entités la libertéou désordre de l'état liquide :
L'énergie cinétique d'agitation microscopique se limite ici aux glissements. Un apport d'énergie peut donner aux entités la libertéou désordre de l'état gazeux (vapeur) :
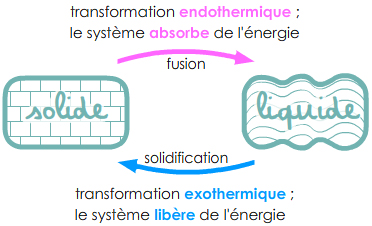
2.1. Exothermique ou endothermique ?
Pour évoquer un transfert d'énergie, il convient de nommer le système étudié pour le distinguer du milieu extérieur ou d'un autre système avec lequel l'énergie sera échangée.
Fusion, vaporisation, sublimation absorbent de l'énergie.
– si un corps purdésigné comme étant le système étudié absorbe de l’énergie thermique, le changement d’état est endothermique ;
Solidification, liquéfaction, condensation libèrent de l'énergie.
– si un corps purdésigné comme étant le système étudié libère de l’énergie thermique, le changement d’état est exothermique.
Remarque : Lors d’une transformation endothermique, l’énergie échangée est positive alors qu’elle est négative lors d’une transformation exothermique. C'est une convention.
Application : La vaporisation est-elle endo ou exothermique ? Justifier.

2.2. Énergie massique de changement d'état
Pendant son changement d'état, le système gagne ou perd une quantité d'énergie Q. Elle est échangée avec le milieu extérieur ou avec un autre système.
Lors du changement d’état d’un corps pur de masse m, l’énergie Q échangée avec le milieu extérieur est égale au produit de sa masse par son énergie massiqueou chaleur latente, ou enthalpie de changement d’état L :
| \( \displaystyle\mathsf {\textit{Q} = \textit{m} \times \textit{L}} \) | Q en J m en kg L en J.kg-1 |
Remarque : les énergies massiques de transformations inverses sont opposées.
Lsolidification = - Lfusion
Exercice 1 : Quelle énergie Q devra absorber la fusion de 213,6 g d'argent ?
Donnée : Energie massique de fusion de l'argent : L = 1,05 x 105 J.kg-1
Exercice 2 : Une masse m = 521 g de plomb liquide se solidifie.
Exercice 2 : Elle cède 1,2 × 104 J d’énergie thermique à l’extérieur.
Exercice 2 : Calculer l’énergie massique de solidification Lsol du plomb.