
1.1. Observations
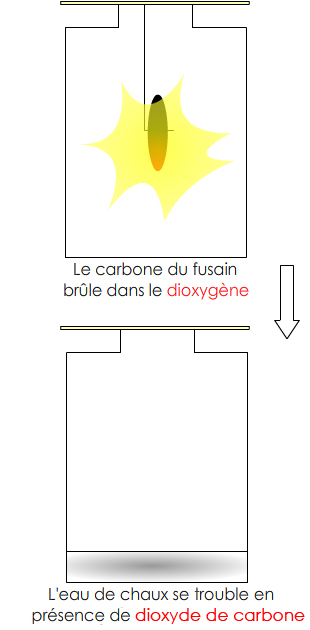
Du carbone brûle dans un flacon de dioxygène.
| Observations | Interprétations | |
|
1. La masse du fusain diminue 2. L'incandescence cesse 3. L'eau de chaux ajoutée se trouble |
→ → → |
1. Du carbone a disparu 2. Le dioxygène a disparu 3. Du dioxyde de carbone est apparu |
Les espèces qui disparaissent sont les réactifs.
Les espèces qui apparaissent sont les produits
Une transformation chimique est le passage d’un système chimique d’un état initialavant la réaction, avant le contact, composé des réactifs, à un état finallorsque le système n'évolue plus, composé des produits.
On observe des variations de couleur, de masse, de température, de pression ou un dégagement gazeux. Des espèces peuvent être mises en évidence grâce à des tests d’identification.
1.2. Réaction chimique
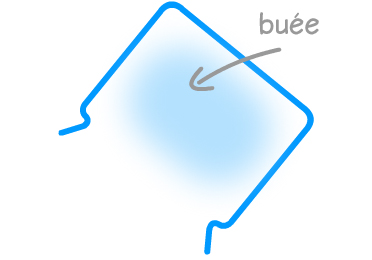
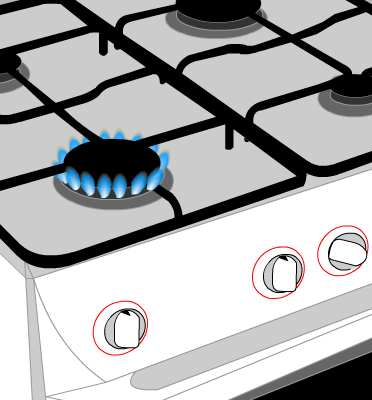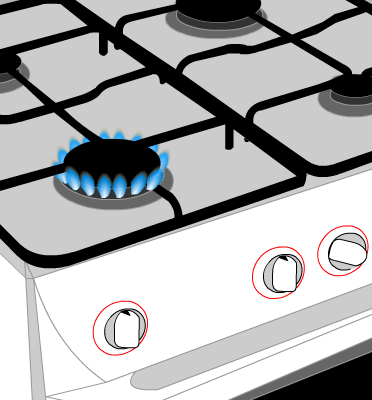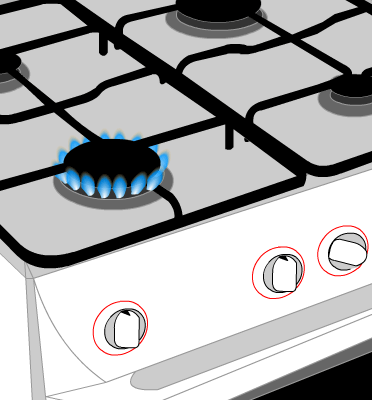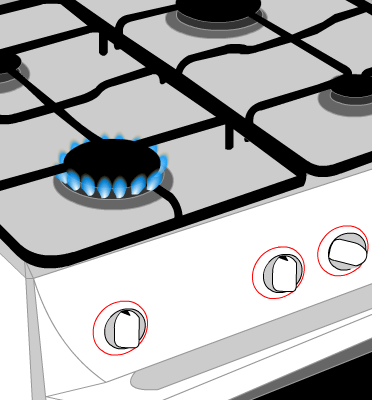
Expérience : On place un récipient en verre épais au dessus de la flamme d'un brûleur de gazinière. Le gaz de ville est du méthane.
Remarque : La combustion du butane des briquets donne les mêmes produits.

| Observations | Interprétations | |
|
1. de la buée apparaît ; 2. l’eau de chaux est troublée |
→ → |
1. de l’eau apparaît ; 2. du dioxyde de carbone apparaît |
AVANT :
méthane (combustible)
dioxygène (comburant)
2 réactifs
APRÈS :
dioxyde de carbone
eau
2 produits
La réaction chimique de combustion complète du méthane dans le dioxygène de l’air s’écrit :
méthane + dioxygène → dioxyde de carbone + eau
Le méthane réagit avec le dioxygène pour donner du dioxyde de carbone et de l’eau.
Le diazote de l'air n'intervient pas dans cette transformation. C'est une espèce chimique spectatrice.
Une réaction chimique est le modèlereprésentation simplifiée d’un phénomène ou d’un système d’une transformation chimique.
Des nombres stœchiométriquesde στοιχεῖον (élément), et μέτρον (mesure), entiers, les plus petits possible, sont placés devant les formules, pour rendre compte des lois de conservation de la matière et de la charge électrique.
Conservation de la matière : Chaque élément est en quantité égale avant et après. C'est la loi de conservation de la matière de Lavoisier.
L'équation de la réaction chimique traduit le bilan de matière qui indique les proportions, en moles, dans lesquelles les réactifs sont consommés et les produits se forment.
L’équation ajustée de la combustion complète du méthane s’écrit :
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g)
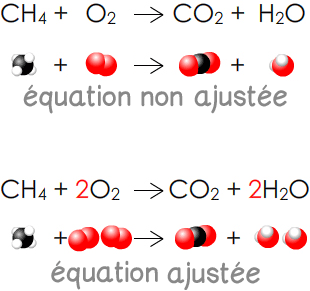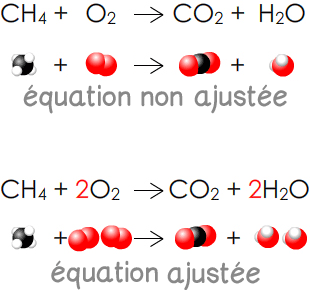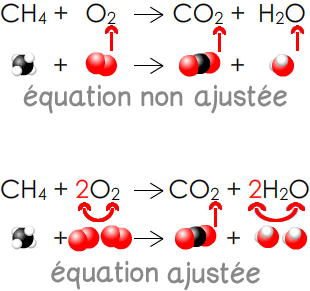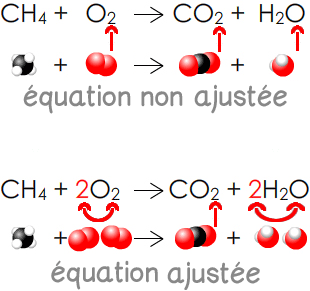
Conservation de la charge : La charge électrique globale des réactifs est identique à celle des produits.
L’équation ajustée de la réaction entre le fer et une solution d'acide chlorhydrique s’écrit :
Fe(s) + 2 H+(aq) → Fe2+(aq) + H2(g)
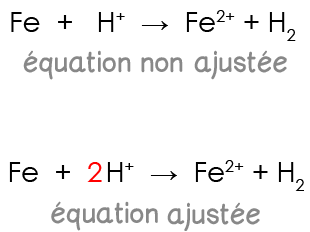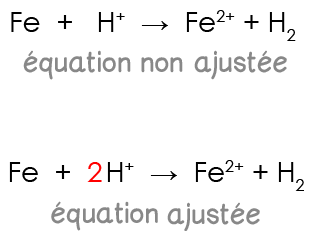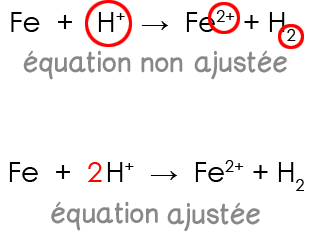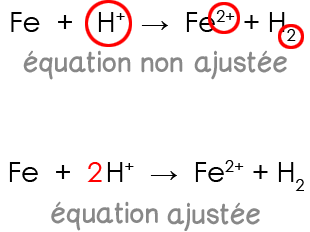
Une réaction chimique cesse dès qu'un réactif a disparu.
Le réactif limitant est celui qui aura disparu en premier.
Identifier le réactif limitant : Deux réactifs A et B, deux quantités initiales ni (A) et ni (B) et deux nombres stoechiométriques a et b.
a A + b B → ...
Si \( \displaystyle\mathsf {\frac{n_{i}(A)}{\color{Cerulean} a}\ =\frac{n_{i}(B)}{\color{magenta} b}} \) A et B disparaissent en même temps
Si \( \displaystyle\mathsf {\frac{n_{i}(A)}{\color{Cerulean} a}\ <\frac{n_{i}(B)}{\color{magenta} b}} \) A est le réactif limitant
Si \( \displaystyle\mathsf {\frac{n_{i}(B)}{\color{magenta} b}\ <\frac{n_{i}(A)}{\color{Cerulean} a}} \) B est le réactif limitant
Exemple : Reprenons l’équation ajustée :
Fe(s) + 2 H+(aq) → Fe2+(aq) + H2(g)
Les quantités de matière initiales sont :
n(Fe) = 8,0 × 10−5 mol et n(H+) = 2,0 × 10−4 mol.
Quel est le réactif limitant ?
Analogie : il faut 1 ressort et 2 branches pour faire une pince à linge
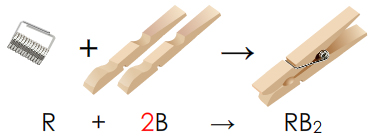
Application : On considère le matériel ci-dessous. Quel est le "réactif limitant" ? Combien de pinces peut-on monter ?

Endothermique :
En absorbant de l’énergie, certaines réactions abaissent le degré énergétique du milieu. La température de ce milieu diminue.
– si une réaction chimique absorbe de l’énergie thermique, le changement d’état est endothermique.
Exothermique :
Lorsqu'une réaction chimique libère de la chaleur dans un milieu, la température de ce milieu augmente.
– si une réaction chimique libère de l’énergie thermique, le changement d’état est exothermique.
Remarque : La température varie d’autant plus que la masse de réactif limitant ayant réagi est grande.
Action de l’acide chlorhydrique sur l’hydroxyde de sodium en solution
H+ + Cl- + Na+ + HO- → H2O + Na+ + Cl-
Les ions Na+ et Cl- sont spectateurs.
H+ + HO- → H2O

Application : La réaction est-elle endo ou exothermique ? Justifier.