Solution = solvant (Liq) + soluté (Sol, Liq ou Gaz)
Le solvant d'une solution aqueuse est l'eau
1.1. Définition
La concentration massique Cm d’une espèce est le quotient de sa masse m par le volume V de la solution
| \( \displaystyle\mathsf {C_{m} = \frac{m}{V}} \) | m en g V en L Cm en g.L-1 |
Remarque : Il convient de distinguer la masse volumique d’un échantillon et la concentration d’un soluté au sein d’une solution. Les unités sont les mêmes.
1.2. Concentration maximale d'un soluté
Lorsque le soluté ne peut plus être totalement dissous, la solution est saturée. La concentration maximale a été atteinte. C'est la solubilité de ce soluté dans ce solvant. Elle dépend de la température.
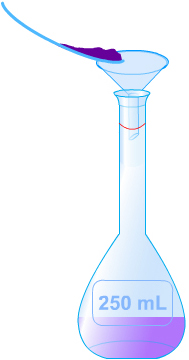
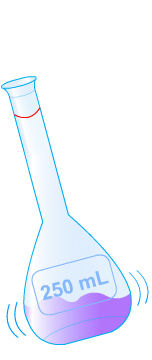
2.1. Par dissolution
Exemple : Préparer 250 mL d'une solution aqueuse S de concentration Cm = 20 g.L-1.
Masse de soluté : m = Cm x V = 20 x 0,25 = 5 g

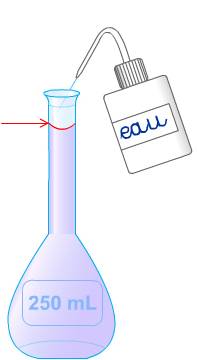
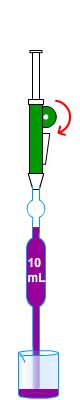
2.2. Par dilution
Exemple : Une solution mère S a une concentration Cm. À partir de S, préparer 100 mL d'une solution diluée 10 fois. Le facteur de dilution sera donc de 10.
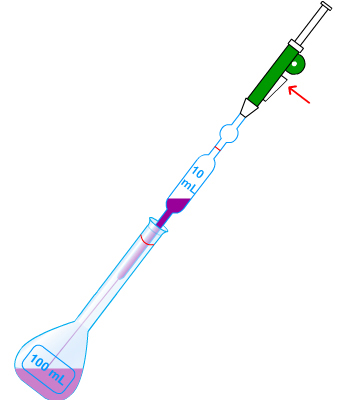
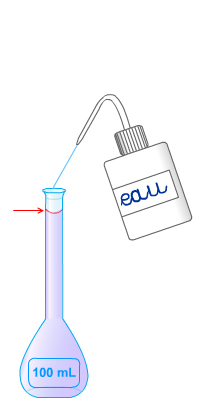
2.3. Conservation de la masse
Pour les deux techniques, la masse de soluté dissous se conserve.
- dissolution : msolution = msoluté + msolvant
- dilution : Au cours de la dilution, la masse de soluté mmère dans le volume Vmère de solution mère prélevé est égale à la masse de soluté mfille dans le volume Vfille de solution fille préparée :
mmère = mfille
soit Cmmère × Vmère = Cmfille × Vfille
Le dosage est l'action qui permet de déterminer la concentration.
Or, aucun appareil ne mesure la concentration en masse.
Mais on peut considérer une propriété (teinte) ou une grandeur mesurable (masse volumique...)liée à la concentration
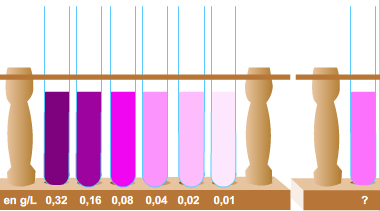
3.1. Échelle de teintes
Une échelle de teintes s'obtient par dilutions successives d'une solution de concentration massique connue.
- Les solutions obtenues sont placées dans des contenants identiques
- Dans l'illustration, le facteur de dilution est 2
Sauriez-vous encadrer la valeur de la concentration en masse inconnue ?
Limites de cette technique : elle est peu précise et ne peut être utilisée que pour les substance colorées.
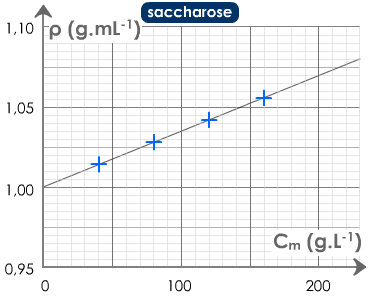
3.2. Courbe d'étalonnage : ρ = f (Cm)
Une courbe d'étalonnage relie la concentration à une grandeur physique mesurable.
Dans l'illustration ci-contre, une courbe d'étalonnage a été obtenue en mesurant les masses volumiques de quatre solutions de saccharose de concentration en masse différentes.
À partir de la courbe d’étalonnage ρ = f (Cm), déterminer la concentration en masse de la solution si la masse volumique mesurée est ρ = 1,05 g.mL-1.