
Le tableau périodique : les éléments chimiques y sont rangés selon leur configuration électronique.
1e ligne ↔ 1 couche : 2 éléments
2e ligne ↔ 2 couches : 8 éléments
3e ligne ↔ 3 couches : 8 éléments
La couche externe porte les électrons de valence.
Dans le tableau périodique, la famille des gaz nobleson dit aussi gaz inertes, ou encore gaz rares se trouve tout à droite. La couche de valence de ces atomes est saturéepleine, complète : on ne peut plus y ajouter aucun électron.
La saturation de leur couche externe leur confère une grande stabilitél'espèce chimique n'évolue pas, ne devient pas une autre entité. Ce sont des gaz monoatomiquescorps simple dont la molécule ne renferme qu'un atome.
L'atome existe dans la nature, seul.

2.1. Charge électrique et place dans le tableau
Un ion monoatomique est stablel'espèce chimique n'évolue plus dès lors que sa couche de valence est saturée, comme celle du gaz noble le plus proche.
| à gauche du tableau → cationsions chargés positivement | à droite → anionsions chargés négativement | |||||
| colonne | 1 | 2 | 3 | 6 | 7 | |
| valence de l'atome | 1 | 2 | 3 | 6 | 7 | |
| pour plus de stabilité | 1 électron cédé | 2 électrons cédés | 3 électrons cédés | 2 électrons captés | 1 électron capté | |
| charge de l'ion | +e | + 2e | + 3e | - 2e | - e | |

2.2. Solides ioniques
Les solides ioniques sont des espèces stables, électriquement neutres, composées de cationsions chargés positivement et d'anionsions chargés négativement.
Application : Le chlorure de baryum est un composé ionique solide de formule BaCl2. Le cation est l'ion baryum. L'anion est l'ion chlorure.
1. Donner la formule de ion chlorure.
2. Que nous dit la formule statistique BaCl2 ?
3. Donner la formule de l'ion baryum.
4. À quelle colonne du tableau périodique l'élément baryum appartient-il ?
Pour avoir un environnement électronique identique à celui d'un gaz noble, les atomes peuvent mettre leurs électrons en commun, toujours pour plus de stabilité. C'est la liaison de valenceou liaison covalente = mise en commun de 2 électrons.
Une molécule est une entité chimique stable et électriquement neutre, formée par au moins deux atomes liés par une liaison de valenceou liaison covalente = mise en commun de 2 électrons.
3.1. Représenter une liaison de valence
Deux électrons, provenants chacun d'un atome différent, et participant à une liaison, forment un doublet liant. Ce doublet liant2 électrons participant à une liaison est représenté par un trait entre les symboles des deux atomes.
Ex. Dans la molécule de dihydrogène H2 : H — H
Remarque : Chaque liaison a une énergie, appelée énergie de liaison, dont la valeur est égale à l’énergie nécessaire pour la rompre.
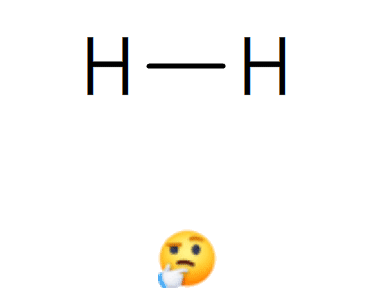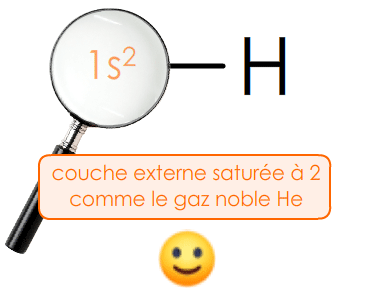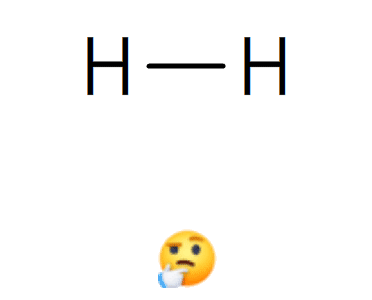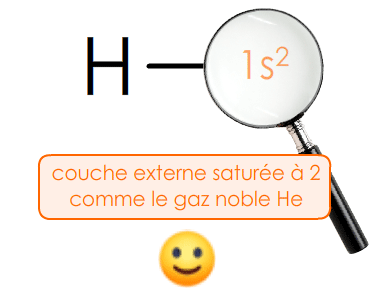
3.2. Schéma de Lewis d'une molécule
Le schéma de Lewisou modèle de Lewis d’une molécule indique l’organisation des électrons de valence de chaque atome.
Ces électrons sont associés :
– en doublets liants ;
– en doublets non-liants, formés par les électrons ne participant pas à la liaison, représentés chacun par un trait autour du symbole.
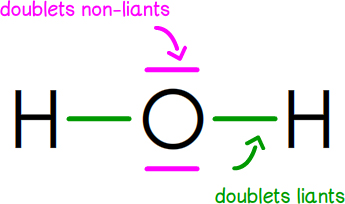
EXEMPLES