
1.1. Corps purs simples
Un corps pur simple est constitué d'un seul type d'atome.
1.2. Corps purs composés
Un corps pur composé est constitué de plusieurs types d'atomes.
Il peut être homogène ou hétérogène.
2.1. Mélange homogène
Les constituants sont impossibles à distinguer.
Il est constitué d'une seule phase.
Exemples : eau/éthanol, eau minérale, eau/sirop
2.2. Mélange hétérogène
On distingue les différents constituants.
Il est constitué de plusieurs phases.
Exemple : l'eau et l'huile ne sont pas miscibles
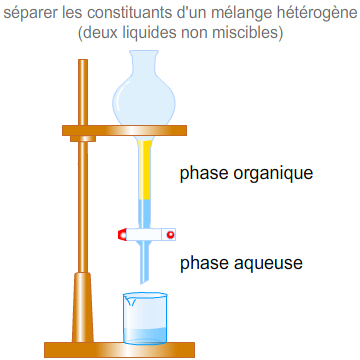
3.1. Identification par les propriétés physiques
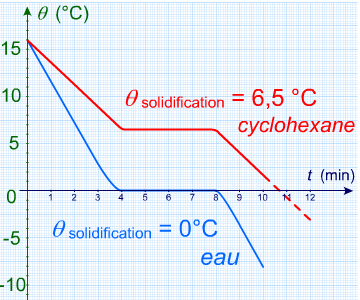
3.1.1. Identification par la température de changement d'état
La température de changement d'état d'un corps pur ne dépend que de l'espèce chimique qui le constitue.
Le protocole expérimental permettant d'obtenir chacune des courbes présentées ici est montré dans les vidéos ↓↓↓
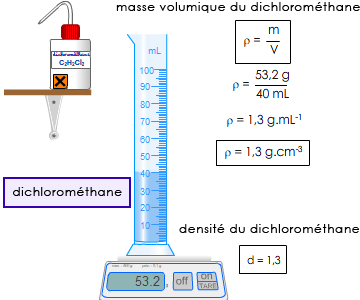
3.1.2. Identification par la masse volumique ou la densité
La masse volumique ρ d’un échantillon de matière est le quotient de sa masse m par le volume V qu’il occupe \( \displaystyle\mathsf {\rho = \frac{m}{V}} \)
La densité d’un liquide ou d'un solide est le quotient de sa masse volumique par celle de l'eau \( \displaystyle\mathsf {d = \frac{\rho}{\rho_eau}} \)
Les valeurs de ces grandeurs sont répertoriées dans des tables de référence.
Protocole expérimental (obtenir ρ et d) dans une vidéo ↓↓↓
3.1.3. Composition d'un mélange
composition en volume
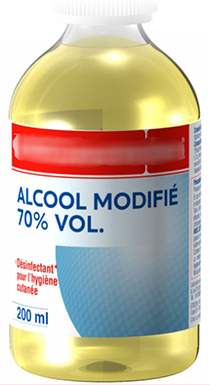
Exemple : Sur un flacon de désinfectant, à base d'éthanol, on lit 70 % VOL.
Quel volume d'éthanol a été placé dans ce flacon de 200 mL ?
composition en masse
Exemple : Sur l'étiquette d'un flacon de désinfectant, on lit : Composition : Éthanol : 64,83 % (m/m).
Quelle masse d'éthanol y a-t-il dans 150 g de cet antiseptique ?
3.1.4. Identification par la chromatographie
La chromatographie sur couche mince est utilisée pour séparer et identifier les constituants d'un mélange par migration le long d'une feuille de papier.
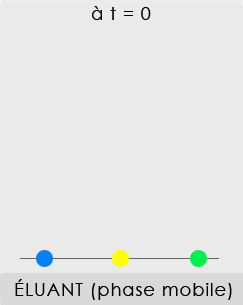
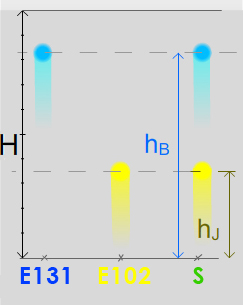
Expérience : Le chromatogramme ci-contre a été obtenu en plaçant, à t = 0, sur la ligne de dépôt, une goutte de bleu E131 ●, de jaune E102 ● et un mélange, la solution S, (goutte de sirop de menthe ●). Ces espèces migrent au passage de l'éluant (eau salée à 20 g/L).
Observation : Le colorant vert était un mélange homogène de bleu et de jaune.
Interprétation : Les rapports frontaux \( \displaystyle\mathsf {R_f{_B} = \frac{h_B}{H}} \) et \( \displaystyle\mathsf {R_f{_J} = \frac{h_J}{H}} \) dépendent des espèces, du matériau fixe et de l'éluant.
Protocole expérimental dans cette vidéo ↓↓↓
3.2. Identification par des tests chimiques
Pour identifier certaines espèces, il existe des tests chimiques.
| on cherche | testé avec | schéma | positif si |
| H2O | sulfate de cuivre anhydre (blanc) | sulfate de cuivre → bleu | |
| CO2 | eau de chaux |  |
trouble |
| O2 | bûchette incandescente | 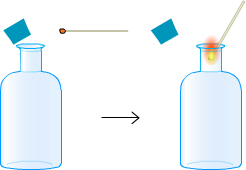 |
la bûchette s'enflamme à nouveau |
| H2 | flamme | 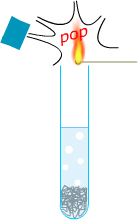 |
"pop" ou flamme pâle |
| Cl- | nitrate d'argent (aq) | 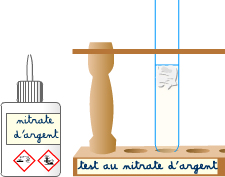 |
précipité blanc qui noircit à la lumière |
| ion métallique | soude (aq) | 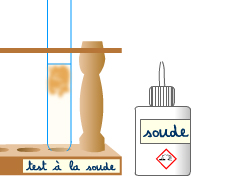 |
précipité |