Le cortège électroniqueou nuage électronique d'un atome est constitué de l'ensemble de ses électrons. Chaque électron porte une charge - e. Un atome possède autant de protons que d'électrons. Il est électriquement neutre.
1.1. Les périodes
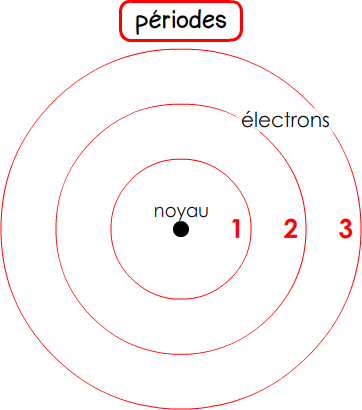
Les électrons sont répartis par couchesou périodes, ou nombre quantique principal.
L'étude se limitera aux atomes possédant au plus 18 protons (Z ≤ 18), et donc au plus 18 électrons.
Les couches sont numérotées 1, 2, 3
couche 1 : saturéepleine, complète : on ne peut plus y ajouter aucun électron à 2 électrons
couche 2 : saturée à 8 électrons
couche 3 : saturée à 8 électrons
La couche externe porte les électrons de valence.
1.2. Les sous-couches
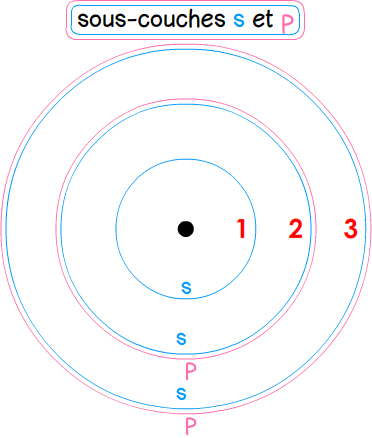
Chaque couche est divisée en sous-couches contenant un nombre limité d’électrons.
sous-couche s : complète à 2 électrons
sous-couche p : complète à 6 électrons
Ordre de remplissage : 1s → 2s → 2p → 3s → 3p
1.3. Écriture de la configuration électronique
La configuration électroniqueou "structure" électronique d'un atome montre la répartition des électrons en sous-couches.
Le nombre d'électrons est en exposant.
Pour l'atome d'aluminium \( \displaystyle\mathsf {^{27}_{13}Al} \) : 1s2 2s2 2p6 3s2 3p1
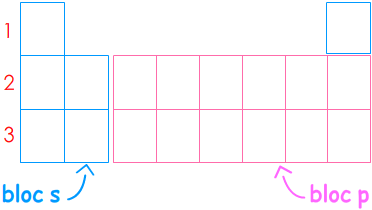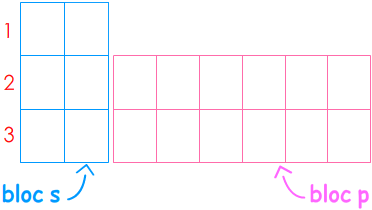
Le tableau périodique : les éléments chimiques y sont rangés par Z ↗, selon leur configuration électronique.
1e ligne ↔ 1 couche : 2 éléments
2e ligne ↔ 2 couches : 8 éléments
3e ligne ↔ 3 couches : 8 éléments
2.1. Configuration électronique → tableau
Pour trouver la place d'un atome dans le tableau, il suffit de compter les électrons. L'atome ayant autant d'électrons que de protons, cela donne Z.
Exemple :
La configuration électronique d'un atome est :
1s2 2s2 2p6 3s2 3p1
Où se trouve l'atome dans le tableau ?

2.2. Tableau → configuration électronique
La place dans le tableau donne :
- Z : pour un atome, c'est le nombre total d'électrons
- la période : nombre de couches, 1, 2 ou 3
- le bloc s ou p : dernière sous-couche
Exemples de configurations électroniques d'atomes :
He : Z = 2, 1e lig. 2e col. du bloc s ⇒ 1s2
N : Z = 7, 2e lig. 3e col. du bloc p ⇒ 1s2 2s2 2p3
Na : Z = 11, 3e lig. 1e col. du bloc s ⇒ 1s2 2s2 2p6 3s1
Exercice : Écrire la structure électronique de
l'atome de magnésium \( \displaystyle\mathsf {^{}_{12}Mg} \)
Tableau et sous-couches :
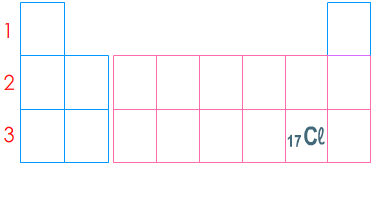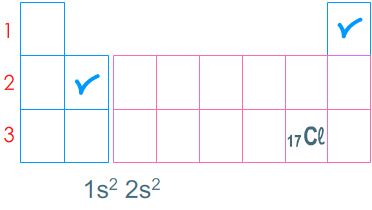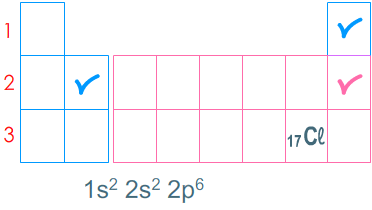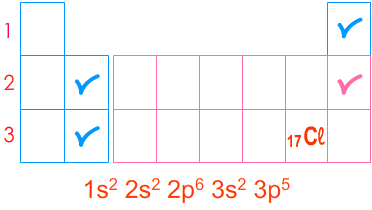
Le tableau pour écrire la configuration électronique de l'atome de chlore \( \displaystyle\mathsf {^{}_{17}Cl} \)