
Cette page est la correction d'une évaluation. Voir le sujet à imprimer
EXERCICE 1 : Le VRAI - FAUX
L'eau et l'alcool sont des liquides miscibles
L’alcool est miscible à l’eau
Dans l’eau sucrée, l’eau est le soluté
La masse de la solution est supérieure à la masse {soluté + solvant}
Pour séparer deux liquides non miscibles, on utilise une ampoule à décanter
Le gaz dissous dans les boissons gazeuses est du dioxyde d’azote
EXERCICE 2 : Une tasse et un bol sont pleins de lait. On introduit deux morceaux de sucre dans chacun d’eux.
EXERCICE 3 : Tu dois préparer une solution aqueuse de sulfate de cuivre constituée de 100 g d’eau et de 8 g de sulfate de cuivre. Rédige un texte expliquant la préparation.
EXERCICE 4 : On réalise l’expérience suivante :
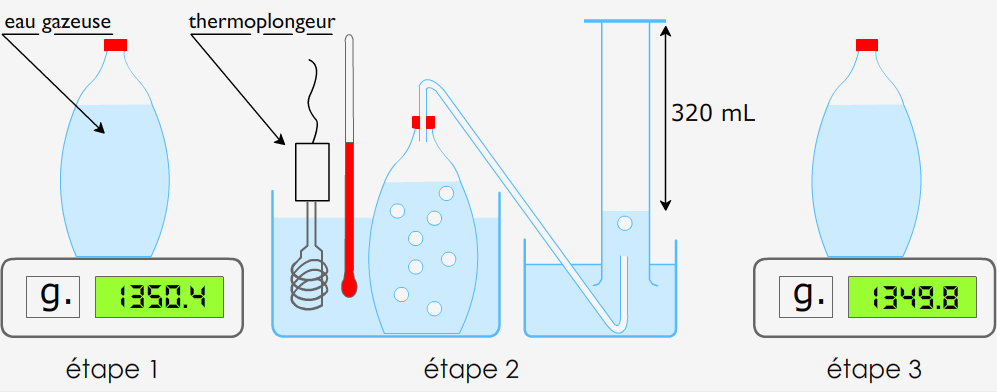
- Masse du gaz recueilli :
m = 0,6 g
0,6 ÷ 320 = 0,001875 g
Masse de 1 L :
0,001875 x 1000 = 1,875 g