VAPORISATION
1. Vaporisation de l'eau pure
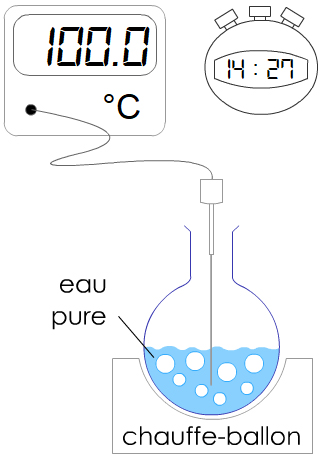
Expérience : On chauffe de l’eau distillée en relevant la température toutes les minutes.
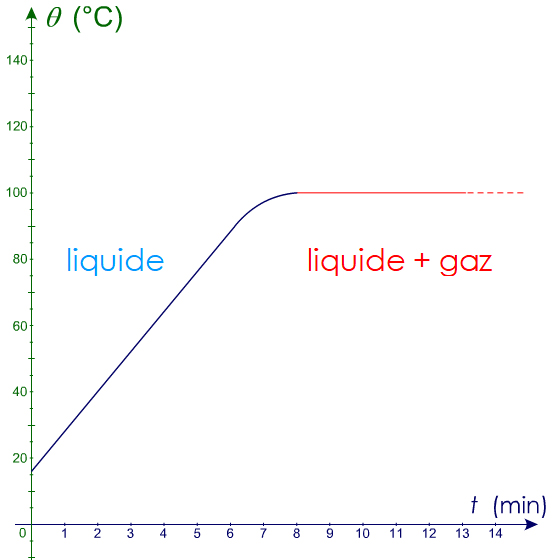
Interprétation : La courbe a deux parties.
‐ Partie 1 : la courbe croît. La température de l’eau augmente. Des petites bulles se forment à 60 °C. C’est du
dioxygène.
‐ Partie 2 : Lorsque la température atteint
100 °C, de grosses bulles apparaissent. L’eau
bout. La température est constante :
palier.
Définition :
A la pression atmosphérique ordinaire, l’eau pure bout à 100 °C.
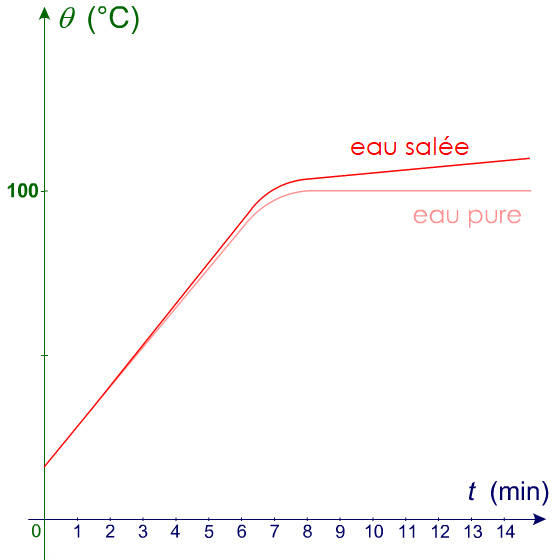
Remarque : Avec l’eau salée (mélange), la courbe ne présente pas de palier.
2. Influence de la pression
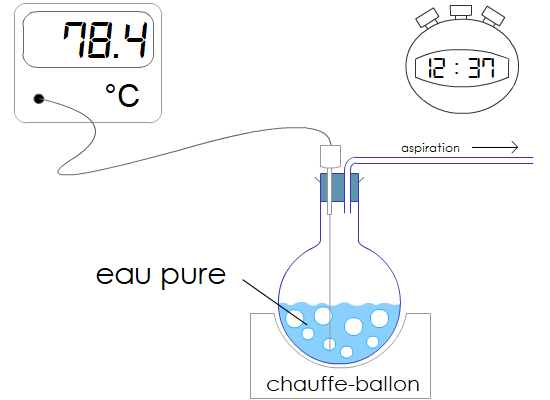
Expérience : On monte un système qui aspire l’atmosphère au dessus de l’eau bouillante. La pression diminue.
Observation : L’eau commence à bouillir à une température inférieure à 100 °C.
Conclusion :
La température d’ébullition dépend de la pression.
Remarque : Vaporisation ≠ évaporation. L’évaporation se passe à la
surface du liquide et à toute température (marais salants, linge
étendu…)
3. La liquéfaction
C'est la réaction inverse de la vaporisation. La liquéfaction est le passage de l'état gazeux à l'état liquide.
Elle se produit par :
- compression : (à la pression atmosphérique, le butane est un gaz ; dans un briquet, il est maintenu comprimé pour être stocké à l'état liquide)
- refroidissement : la vapeur d'eau se liquéfiee au contact de l'air froid ou de la surface froide d'un matériau (la buée sur les vitres de la voiture, l'hiver, vient de la liquéfaction de la vapeur d'eau que nous expirons ; la bouteille d'eau fraîche se couvrira de buée si l'air ambiant est humide ; il n'y a pas de buée sur le verre d'une boisson glacée au Sahel, en saison sèche)